ACTIVIDAD EXTRACLASE
Resuelve la actividad hecha en clase, pero empleando ahora los valores de potencial de ionización y afinidad electrónica. Resuelve de igual manera las preguntas formuladas para la electronegatividad, teniendo en cuenta ahora las propiedades de potencial y afinidad electrónica. Usa los siguientes link para consultar dichos valores.
http://www.lenntech.es/tabla-peiodica/energia-de-ionizacion.htm
https://www.uam.es/docencia/elementos/spV21/conmarcos/graficos/afinidadelectronica/afinidad.html
18-07-16
Hola queridos estudiantes:
Necesito que me confirmen si este 11 de julio inician clases en el Liceo, para programar clases, ya que me informaron que ustedes ingresan el 12 de julio, es por esto que las actividades que a continuación se relacionan se programan para el 18 de julio. Estaré atenta a su información.
A continuación relaciono los temas y competencias del tercer período para que las copien o las impriman:
PROPIEDADES PERIODICAS
Electronegatividad
Tamaño atómico
Potencial de ionización
Afinidad electrónica
Comprender el comportamiento químico de los elementos de acuerdo a sus propiedades periódicas
ENLACE QUÍMICO
FORMULAS QUÍMICAS
Aplica las
estructuras de Lewis para comprender las fórmulas de los compuestos químicos, según la ley del octeto.
GRUPOS FUNCIONALES
Formulación y
nomenclatura:
Óxidos
Hidróxidos
Ácidos
Sales
Formular y
nombrar compuestos inorgánicos empleando
las reglas de la IUPAC
ACTIVIDADES DE CLASE:
Con la ayuda de la tabla periódica, resolver:
6. TALLER PROPIEDADES
ELECTRONEGATIVIDAD:
Escribe la información solicitada en la siguiente tabla teniendo en cuenta los primeros 30 elementos de la tabla periódica.
Elemento
|
Símbolo
|
z
|
Carácter
|
Valor
|
Registra los datos anteriores en un plano cartesiano y con base en el resuelve las siguientes preguntas:
a. Cual es el elemento con mayor electronegatividad? Qué carácter presenta?
b. Cual es el elemento con menor electronegatividad? Qué carácter presenta?
c. Organice los elementos de menor a mayor electronegatividad.
d. Elabore el croquis de la tabla periódica e indique con flechas la variación de esta propiedad por periodos y grupos.
e. Que entiende por electronegatividad?
f. Escriba mínimo 3 conclusiones de lo observado n la tabla.
Repita cada paso anterior, teniendo en cuenta:
a. Tamaño atómico
b. Potencial de ionización
c. Electroafinidad.
13-06-16
Listado de estudiantes con desempeño básico a la fecha:
| ACOSTA NATALIA CARVAJAL |
CERVERA
|
ACTIVIDAD DE CLASE
Presentar la pregunta asignada tomada del texto guía (12 en total) con su respectivo argumento. A continuación relaciono las preguntas para ser resueltas a partir del código 13 en adelante y la entreguen también con los respectivos argumentos: Seleccionar desde la pregunta 3 en adelante, una sola pregunta.
Evaluación ICFES del átomo y de la Tabla periódica.
Evaluación de los símbolos, nombres y número atómico a los 50 primeros elementos de la Tabla periódica. Favor estudiar.
ACTIVIDAD DE NIVELACIÓN PARA LOS ESTUDIANTES CON DESEMPEÑO BAJO PARA SER RESUELTAS Y PRESENTADAS EN UNA RESPECTIVA CARPETA. EN CLASE SE HARÁ LA SUSTENTACIÓN
https://drive.google.com/file/d/0By5yvVI7Ql2Ma29KT2IyakNxLTQ/view?usp=sharing (RESOLVER DE LA PREGUNTA 1 A LA 30)
4-06-16
El próximo sábado 4 de junio se programan 3 horas de clase, para reponer la clase del festivo 30 de mayo. Inicia a las 8:00 y finaliza a las 11:00 a.m.
Me gustaría trabajar de 7:00 a 12:00 para reponer de una vez las clases de los días 30 de mayo y 6 de junio (días festivos) y no citarlos el próximo sábado 11 de junio. Por favor confirmar en el blog la decisión del curso.
ACTIVIDAD DE CLASE
Explicar determinación de período y grupo con la ayuda de la distribución electrónica y distribución general para los elementos de la tabla periódica.
Quiz de las explicaciones dadas.
Quiz de símbolos, nombres y números atómicos.
Desarrollo de las siguientes actividades en clase:

Clasifica los siguientes elementos en: Metal alcalino, metal alcalinotérreo, metal de transición, metaloide, no metal, halógeno, gas noble, región s, región p, región d, región f, lantánido y actínido.
a. Aluminio
b. Azufre
c. Calcio
d. Cerio
e. Einstenio
f. Escandio
g. Flúor
h. Francio
i. Germanio
j. Hidrógeno
k. Hierro
l. Indio
m. Kriptón
n. Neodimio
o. Neón
p. Oxigeno
q. Potasio
r. Radón
s. Yodo
t. Zinc
u. Zirconio
Indica el nivel valencia y electrón valencia a los elementos del punto anterior.
2. Indica el grupo, el periodo y la región en el que se encuentran los siguientes elementos. Realiza la configuración electrónica para cada uno.
a. Al
b. B
c. Br
d. C
e. Ca
f. Cl
g. Fe
h. Ge
i. H
j. Hg
k. Ne
l. Pd
m. Sn
Exposición de los argumentos a las preguntas ICFES de los temas átomo y tabla periódica, tomados del texto guía según el código de lista.
Socialización de la segunda competencia y actividad de motivación:
Aplica las estructuras de Lewis
para comprender las fórmulas de los
compuestos químicos, según la ley del octeto.
1° Observa los siguientes
modelos atómicos y resuelve:
Figura A:
|
Elemento
|
Símbolo
|
A
|
Z
|
P+
|
e-
|
no
|
D.e.
|
Figura B
|
Elemento
|
Símbolo
|
A
|
Z
|
P+
|
e-
|
no
|
D.e.
|
De acuerdo a lo observado
que compuesto químico se forma de dicha unión? Escribe su fórmula molecular y
estructural.
Que elemento gana
electrones? Por qué?
Que elemento pierde
electrones? Por qué?
Por qué se enlazan los
átomos?
Que se forma de dicha unión?
ACTIVIDAD DE CLASE
1°Resolver para el 23 de mayo las preguntas propuestas en las siguientes páginas propuestas en su texto guía: 46, 47, 48, 49, 52, 53,54,58,59.
2° Exponer de los argumentos a las preguntas ICFES propuestos en su texto guía páginas 60 y 61, de acuerdo al número de lista: Código 1 pregunta 1 y así sucesivamente.
3° Quiz de los elementos de la tabla periódica: Grupos A de la tabla periódica.
4° Resolver:
Cuantos y que elementos pertenecen a los 7 periodos de la tabla Periódica?
Cuantos y que elementos pertenecen a los grupos A y B de la tabla Periódica?
Prediga la distribución electrónica a los siguientes elementos químicos empleando su fórmula general: cloro, vanadio, fósforo, sodio, oro, hierro, azufre, plomo, argón, rubidio, plata.
Indique el parecido químico a cada uno de los grupos de elementos:
Litio, potasio, francio.
Calcio, vanadio, hierro, zinc, kriptón.
Carbono, estaño, plomo.
Rubidio, oro, bismuto, Radón, osmio.
Apoyado en la distribución electrónica prediga el periodo y grupo a los siguientes elementos químicos:
Aluminio Z: 13
Níquel Z: 28
Flúor Z: 9
Escandio Z: 21
Bromo Z: 35
Cesio Z: 55
Zinc Z: 30
Argón Z: 18
Indique el nivel de valencia y electrón de valencia a los elementos del punto 1 D.
Favor imprimir la siguiente imagen para trabajarla en clase. Favor no olvidar estudiar los símbolos y nombres de los elementos de la Tabla Periódica, ya que se seguirá evaluando en clase-.
Favor imprimir la siguiente imagen para trabajarla en clase. Favor no olvidar estudiar los símbolos y nombres de los elementos de la Tabla Periódica, ya que se seguirá evaluando en clase-.

16-05-16
Hola muchachos, felicidades por la disposición para con las actividades de la clase pasada.
A partir de éste lunes seguiremos saliendo a las 6:00 p.m para reponer los dos lunes festivos del mes de mayo.
A partir de éste lunes seguiremos saliendo a las 6:00 p.m para reponer los dos lunes festivos del mes de mayo.
ACTIVIDADES DE CLASE:
2° Explicar el tema de masa atómica, número atómico, p+, e-, no.
3° Explicar el tema de Isotopos. Favor llevar la tabla periódica.
4° Resolver:
5° Quiz del tema modelos atómicos.
6° Revisión de la actividad extraclase: publicada el 2 de mayo
7° Resolver para el 23 de mayo las preguntas propuestas en las siguientes páginas propuestas en su texto guía: 46, 47, 48, 49, 52, 53,54,58,59.
8° Exponer para el 26 de mayo los argumentos a las preguntas ICFES propuestos en su texto guía páginas 60 y 61, de acuerdo al número de lista: Código 1 pregunta 1 y así sucesivamente.
9-05-16
DIA FESTIVO
2-05-16
ACTIVIDADES DE CLASE:
1° Evaluación ICFES sobre mezclas y métodos de separación. Los espero bien preparados, ya que esta evaluación estaba programada para el 25-04.
3°Explicar los modelos atómicos
1° Menciona aciertos y fallas en los modelos atómicos propuestos por:
Autor
|
Aciertos
|
Fallas
|
Jhon Dalton
| ||
J.J. Thomson
| ||
Ernest Rutherford
| ||
Niels Bohr
|
2° Establezca un paralelo de semejanzas y diferencias entre los siguientes autores:
a. Jhon Dalton y J.J. Thomson
Semejanzas
|
Diferencias
|
3° J.J. Thomson y Ernest Rutherford
Semejanzas
|
diferencias
|
4° Ernest Rutherford y Niels Bhor:
Semejanzas
|
diferencias
|
Desarrollar el taller del átomo propuesto en la guía:
Taller de repaso Tema: “EL ATOMO”
1º Diga si es Falso o verdadero, argumentando las afirmaciones falsas:
a. Los protones se localizan en la periferia del átomo. ( )
________________________________________________________________________________________________________________________
b. Al sumar protones con electrones se determina la masa del átomo ( )
________________________________________________________________________________________________________________________
23
c. Los neutrones que presenta el átomo de Na son 11 ( )
11
________________________________________________________________________________________________________________________
31
d. El numero de protones que presenta el átomo de P es 10 ( )
15
_____________________________________________________________
_____________________________________________________________
2 2 3
e. Según la distribución del átomo de Nitrógeno: 1s 2S 2P la representación del su átomo es ( )_________________________________
Los àtomos presentan 5 niveles de energía representados con las letras: K, L, M, N, O. ( )
______________________________________________________
Completar:
2° Completa la siguiente tabla:
Elemento
|
A
|
Z
|
no
|
P+
|
e-
|
80
Br
35
| |||||
__
Cl
__
|
18
|
17
| |||
___
K
__
|
39
|
19
| |||
___
Fe
___
|
30
|
26
|
ACTIVIDAD EXTRACLASE:
Favor presentarla para el 16 de mayo de 2016, para ello pueden consultar el texto guía.
Escriba en el siguiente cuadro, la descripción de la teoría propuesta por los científicos, que contribuyeron en el estudio y comprensión de la materia: La fotocopia se entrega en clase.
AUTOR
|
TEORÍA PROPUESTA
|
Tales de Mileto
| |
Gilbert
| |
Michael Faraday
| |
Jhon Dalton
| |
William Crookes
| |
Henry Becquerel
| |
Ernest Rutherford
| |
Henry Moseley
| |
Robert Millikan
| |
Joseph Jhon Thomson
| |
Max Planck
| |
Niels Bohr
| |
Schrödinger
| |
Luis de Broglie
|
2° Consulta el significado de los siguientes términos, acompaña cada definición de su respectivo dibujo:
a. Spin
b. Nivel de Energía
c. Orbital
d. D. Subnivel de energía
e. Espectroscopio
f. Radiactividad
g. Rayos Alfa
h. Rayos Beta
i. Rayos Gama
j. Rayos x
k. Absorción
l. Emisión
Fuerza Centrifuga
n. Fuerza Centrípeta
o. Cátodo
p. Ánodo
q. Cuanto
Evaluación ICFES sobre mezclas y métodos de separación. Favor estudiar.
2° Práctica de laboratorio.
Determinar volumen de objetos regulares e irregulares:
Para ello favor imprimir y pegar en el cuaderno la siguiente tabla:

Favor llevar en lo posible sólidos con las formas geométricas expuestas. De igual manera llevar regla y calculadora.
3° Explicar el tema del átomo: Organización, distribución electrónica, niveles y modelos.
Taller sobre la distribución electrónica para los elementos representativos de la Tabla Periódica y conclusión.
18-04-16
Hola apreciados estudiantes:
Continuaremos con el desarrollo de las prácticas de laboratorio que quedaron pendientes la semana pasada.
Nos vemos Dios mediante el próximo lunes recargados de muchaaa energía.
11-04-16
Hola apreciados estudiantes:
A continuación relaciono las competencias y temas del segundo período, para que por favor las copien al cuaderno o impriman:
ACTIVIDADES DE CLASE:
Laboratorio de propiedades de la materia. No olvidar traer los materiales solicitados en la siguiente tabla.
Propiedades Físicas:
Propiedades Químicas:
4-04-16
Se evaluará el tema de material de laboratorio, por favor estudiar al respecto.
No olviden estudiar y preparar para exposición la pregunta asignada del libro según código.
No olviden diligenciar y pegar en el cuaderno la evaluación de la dimensión formativa..
Te deseo una feliz Semana Santa y recibe con amor a Dios en tu corazón.

28-03-16
ACTIVIDADES DE CLASE:
1° Revisión y valoración del taller evaluativo:
Completa la información solicitada en la siguiente tabla:
Completa la información solicitada en la siguiente tabla: Basada en la información de la tabla anterior.

Dibuja el orden en el que se ubicarían los componentes de cada una de las siguientes mezclas y luego resuelve los interrogantes allí propuestos:

Resolver y estudiar el siguiente taller evaluativo:
2° EVALUACIÓN ESCRITA DE:
MATERIA: PROPIEDADES, ESTADOS, CLASES, CAMBIOS Y TÉCNICAS DE SEPARACIÓN.
CONVERSIÓN EN UNIDADES DE LONGITUD, MASA, VOLUMEN, MOL Y TEMPERATURA
MATERIAL DE LABORATORIO
3°Copiar en el cuaderno o imprimir el siguiente formato y diligenciar la autoevaluación y coevaluación.
Acciones de Mejora:
Acciones Correctivas:
Acciones Preventiva:
14-03-16
ACTIVIDADES DE CLASE:
Explicación del tema de mezclas, métodos de separación y densidad.
Resolver los siguientes ejercicios:
29-02-16
ACTIVIDADES DE CLASE:
Repaso del tema de conversiones:
Masa
Volumen
Quiz del tema
Tablas de conversión
Explicación del tema: Mezclas y métodos de separación, con la ayuda del siguiente vídeo:
Explicación del reconocimiento del material de laboratorio:
Practica de laboratorio:
Reconocimiento del material de laboratorio
Favor traer bata de laboratorio e impresa la siguiente guía:
Para resolver en CASA:
22-02-16
Hola estudiantes:
Los invito a reflexionar sobre la necesidad de asumir el verdadero rol del estudiante: Inquieto por saber, dinámico, exigente con sigo mismo, entre otros.
Piensen en la necesidad de lograr unos excelentes resultados en las PRUEBAS SABER, por lo tanto deben mejorar aspectos académicos del grado décimo.
ACTIVIDADES DE CLASE:
Revisión y sustentación de los ejercicios referentes a Longitud, masa y volumen.tomados del siguiente link:
Resolver: http://matebrunca.com/wp-content/uploads/2014/06/fisica-conversion-unidades.pdf
Quiz del tema: Conversión en unidades de longitud.
Resolver en clase el siguiente taller:
15-02-16
ACTIVIDADES DE CLASE:
Explicación del sistema de medidas, con la proyección de un vídeo:
Desarrollo de la siguiente actividad:
http://www.ilse.esc.edu.ar/MATERIAL_FISICA_QUIMICA/Betty/Trabajo%20practico%20inicial%20Quimica%202014.pdf
08-02-16
 Resolver:
Resolver:
7° Realice la curva de enfriamiento y de calentamiento del agua. No olvide indicar estados, cambios de estado y las temperaturas.
Determinar volumen de objetos regulares e irregulares:
Para ello favor imprimir y pegar en el cuaderno la siguiente tabla:

Favor llevar en lo posible sólidos con las formas geométricas expuestas. De igual manera llevar regla y calculadora.
Determinación de masas
Determinación de volumen de sólidos no regulares
Determinación de densidad de sólidos y líquidos: Traer pequeñas cantidades de: alcohol, vinagre, orines, glicerina, leche
DENSIDAD DE LÍQUIDOS
SUSTANCIA
|
Masa Final
|
Masa Inicial
|
Masa: g
Mf-Mi
|
Volumen: ml
|
Densidad: g/ml
D:m/v
|
Agua
| |||||
Alcohol
| |||||
Ácido Acético
| |||||
Leche
| |||||
Glicerina
|
DENSIDAD DE SÓLIDOS
SUSTANCIA
|
Volumen Final
|
Volumen Inicial
|
Volumen: ml
Vf-Vi
|
Masa: g
|
Densidad: g/ml
D:m/v
|
Borrador
| |||||
Anillo
| |||||
Piedra
| |||||
Piedra
| |||||
Dado
|
3° Explicar el tema del átomo: Organización, distribución electrónica, niveles y modelos.
Taller sobre la distribución electrónica para los elementos representativos de la Tabla Periódica y conclusión.
18-04-16
Hola apreciados estudiantes:
Continuaremos con el desarrollo de las prácticas de laboratorio que quedaron pendientes la semana pasada.
Nos vemos Dios mediante el próximo lunes recargados de muchaaa energía.
11-04-16
Hola apreciados estudiantes:
A continuación relaciono las competencias y temas del segundo período, para que por favor las copien al cuaderno o impriman:
ORGANIZACIÓN INTERNA DE LA MATERIA
Reconoce la
composición interna de las sustancias, para comprender el comportamiento de la
materia a partir de un modelo discontinuo de la materia.
TABLA PERIÓDICA
Caracteriza e
interpreta la estructura de la tabla periódica, para comprender el
comportamiento de los elementos, de acuerdo con sus propiedades periódicas y su
aplicación en la formación de compuestos.
Laboratorio de propiedades de la materia. No olvidar traer los materiales solicitados en la siguiente tabla.
Propiedades Físicas:
Sustancia
|
Símbolo
|
Z
|
A
|
P.f
|
p.eb
|
Densidad
|
Color
|
Olor
|
Textura
|
Aspecto
|
Brillo
|
Hierro
| |||||||||||
Azufre
| |||||||||||
Aluminio
| |||||||||||
Plata
| |||||||||||
Carbono
| |||||||||||
Cobre
| |||||||||||
Estaño
| |||||||||||
Plomo
| |||||||||||
Cromo
|
Propiedades Químicas:
Reactivo 1
|
Reactivo 2
|
Cambios Físicos
|
Cambios químicos
|
Observaciones
|
sodio
|
Agua
| |||
Azufre
|
Oxigeno
| |||
Magnesio
|
Oxigeno
| |||
Organizados en grupos de dos estudiantes consigue los siguientes materiales para realizar una interesante práctica de laboratorio:
Aceite de cocina
Glicerina
Miel
Vinagre
Alcohol
Sal
Azúcar
Bicarbonato de sodio
Azufre
Limadura de hierro
Leche
Jugo de limón
Llevar copiado o impreso en el cuaderno de laboratorio la siguiente tabla:
Sustancia A
|
Sustancia B
|
Estado
Sustancia A
|
Estado
Sustancia B
|
Propiedades Físicas
Sustancia A
|
Propiedades
Físicas Sustancia B
|
No. De fases
|
Tipo de Mezcla
|
Favor traer los siguientes materiales:
TEMA: Métodos de separación de mezclas
Objetivo:
Aplicar técnicas para separar mezclas homogéneas y heterogéneas a sustancias del entorno, mediante el reconocimiento de las propiedades de sus componentes a separar.
Separación de mezclas homogéneas:
Evaporación:
Materiales e implementos
Bata, Cloruro de sodio, agua, tubos de ensayo, mechero de alcohol, agitador, pinzas de madera.
Procedimiento:
Toma un tubo de ensayo y agrega 3 ml de agua, luego 10 g de cloruro de sodio, mezcla con el agitador hasta obtener una mezcla homogénea. Toma el mechero, enciende y acerca el tubo de ensayo presionado con la pinza, hasta que el cloruro de sodio precipite, cuando el agua haya evaporado.
Separación de mezclas heterogéneas: Imantación:
Materiales e implementos.
Imán, harina de trigo, limadura de hierro, caja de petri, espátula.
Procedimiento:
Toma la caja de petri, coloca un poco de harina de trigo, luego agrega limaduras de hierro, mezcla y acerca el imán hasta separarse el hierro.
Separación de mezclas heterogéneas: Filtración
Materiales e implementos:
Papel filtro, embudo, beaker, agua, arena , agitador.
Procedimiento: realiza una mezcla de agua y bicarbonato de sodio, prepara el embudo con el papel filtro siguiendo las instrucciones del docente, luego vierte la mezcla y recoge el liquido en el beaker.
Separación de mezclas heterogéneas: Decantación de sólidos:
Materiales e implementos:
Papel filtro, embudo, beaker, agua, arena , agitador.
Procedimiento: realiza una mezcla de agua y arena, agita y deja sedimentar el precipitado,l uego vierte la mezcla y recoge el liquido en otro beaker.
Separación de mezclas homogéneas: Decantación de líquidos:
Materiales e implementos.
Embudo de decantación, aceite, agua, beaker.
Procedimiento:
En el embudo de decantación agrega 150 ml de agua, agrega 50 ml de aceite, manipula la llave y deja decantar el agua, cuando esta haya salido completamente cierra la llave.
4-04-16
A continuación relaciono la lista de estudiantes que presentan desempeño bajo en la dimensión cognitiva, por lo tanto se les recomienda estudiar y proponer 10 ejercicios de cada tema de conversión de unidades en longitud, masa, volumen, mol, temperatura; ya que se pasarán al tablero en forma individual, pues considero conocimientos indispensables para el segundo período.
ACOSTA RODRIGUEZ NATALIA
ACOSTA RODRIGUEZ YESSICA
CALDERON
CASALLAS
CERVERA
LAMUS
MONTEALEGRE
MONTES
MURILLO
PARRA
PEÑARANDA
RODRIGUEZ PEREZ
RODRIGUEZ RODRIGUEZ
ROJAS
ROMERO
SANCHEZ
TRJILLO
TURIZO
VASQUEZ
Se evaluará el tema de material de laboratorio, por favor estudiar al respecto.
No olviden estudiar y preparar para exposición la pregunta asignada del libro según código.
No olviden diligenciar y pegar en el cuaderno la evaluación de la dimensión formativa..
Te deseo una feliz Semana Santa y recibe con amor a Dios en tu corazón.

28-03-16
ACTIVIDADES DE CLASE:
1° Revisión y valoración del taller evaluativo:
1. Con una X sobre la letra marque la respuesta correcta una y solo una respuesta:
1. Los Procesos físicos, actúan sobre la materia:
a. Transformándola b. Cambiando sus propiedades físicas.
c. No le cambian sus propiedades físicas. d. Ninguna de las anteriores.
2. La masa es:
a. Cantidad de materia b. La densidad de la materia
c. El peso de la materia d. Ninguna de las anteriores.
3. Son estados fundamentales de la materia:
a. Sólido y líquido b. Gaseoso y coloidal
c. Sólido, líquido, gaseoso y plasma d. Plasma y coloidal
4. Los coloides son:
a. Estados fundamentales de la materia b. Estados intermedios de la materia
c. Estado vesicular de la materia d. Ninguno de los anteriores.
5. En el estado sólido las fuerzas de las moléculas son:
a. De atracción menor que de repulsión b. De atracción igual que de repulsión
c. De repulsión mayor que de atracción d. Las fuerzas de las moléculas no existen
6. Sustancias formadas por la misma clase de átomos de denominan:
a. Moléculas b. Elementos químicos
c. Compuestos químicos d. Gases
7. Ductilidad es la propiedad que presentan los cuerpos para:
a. Dejarse convertir en láminas b. Combinarse fácilmente con otro cuerpo
c. Poderse separar por medios mecánicos d. Dejarse convertir en hilos.
8. El agua es:
a. Un elemento químico b. Un compuesto químico
c. Una solución d. Una mezcla
9. El aire es:
a. Un elemento químico b. Un compuesto químico
b. Una mezcla homogénea c. Una mezcla heterogénea
10. La temperatura se mide con:
a. El termómetro b. La balanza
c. El dinamómetro d. El barómetro.
11. Una sopa de legumbres es:
a. Un elemento químico b. Un compuesto química
b. Una mezcla homogénea c. Una mezcla heterogénea
12. El cambio de estado de gas a líquido se denomina:
a. Condensación b. Fusión
c. Sublimación d. Condensación
2. A. Identifique como propiedad física (F) o como propiedad química (Q) lo siguiente:
1. _____ Una botella de gaseosa se empaña al retirarla de la nevera
2. _____ La gasolina de enciende en los cilindros de un motor
3. _____ Un clavo de hierro es atraído por un imán
4. _____ Un helado se derrite cuando se expone al sol
5. _____ El éter es una sustancia fácilmente inflamable
6. _____ El agua es incolora
7. _____ Al quemar el papel se transforma en carbón
8. _____ Juanita tiene los ojos verdes
9. _____ El alcohol es un líquido de olor fuerte
10. _____ Los metales en presencia del oxígeno se oxidan
2.B. Clasifique los siguientes cambios como físicos (F) o como químicos (Q)
1. _____ Formación de nubes en la atmósfera
2. _____ Putrefacción de la carne
3. _____ Fusión del hielo de los casquetes polares
4. _____ Proceso de la digestión
5. _____ Combustión de la madera
6. _____ Preparar café con leche
7. _____ La carne se volvió carbón
8. _____ Solidificación del agua
9. _____ Ruptura de vasos sanguíneos
10. _____ Incendio forestal
3A. Completa la siguiente tabla con una X en el cuadro correspondiente
Sustancia
|
Mezcla
|
Sustancia pura
| ||
Heterogénea
|
Homogénea
|
Compuesto
|
Elemento
| |
Azúcar
| ||||
Agua de mar
| ||||
Aire
| ||||
Mayonesa
| ||||
Gasolina
| ||||
Hielo seco
| ||||
Amoniaco
| ||||
Detergente
| ||||
Alambre de cobre
| ||||
Gas que expele el exhosto de un auto
| ||||
4. A. Escriba como se llama los siguientes cambios y si se requiere aumento o disminución de temperatura:
a. Sólido a líquido: ___________________________La temperatura _____________________
b. Líquido a gas: ___________________________La temperatura _____________________
c. Gas a sólido: ___________________________La temperatura _____________________
d. Líquido a sólido: ___________________________La temperatura _____________________
e. Gas a líquido: ___________________________La temperatura _____________________
Completa la siguiente tabla:
Aspecto
|
Estado sólido
|
Estado líquido
|
Estado gaseoso
|
Ordenamiento de las partículas
| |||
Movimiento
| |||
Cercanía de las partículas
| |||
Fuerzas intermoleculares
| |||
Volúmen y forma
|
Completa la información solicitada en la siguiente tabla:
Sustancia 1
|
Sustancia 2
|
Estado
|
Aspecto
|
Solubilidad
|
No. fases
|
Tipo de mezcla
| |||
1
|
2
|
1
|
2
|
si
|
no
| ||||
Agua
|
Aceite
| ||||||||
Sal
|
Agua
| ||||||||
Agua
|
Alcohol
| ||||||||
Azufre
|
Hierro
| ||||||||
Arena
|
Agua
| ||||||||
Azufre
|
Agua
| ||||||||
Agua
|
Vinagre
| ||||||||
Completa la información solicitada en la siguiente tabla: Basada en la información de la tabla anterior.
Mezcla
|
Material a emplear
|
Técnica a emplear
|
Montaje
|
A
| |||
B
| |||
C
| |||
D
| |||
E
| |||
f
| |||
g
|
Dibuja el orden en el que se ubicarían los componentes de cada una de las siguientes mezclas y luego resuelve los interrogantes allí propuestos:
Resolver y estudiar el siguiente taller evaluativo:
1. Selecciona en cada caso la respuesta correcta:
- I. La cuarta parte en centímetros de 20 m es:
____ 40 cm
____ 400 cm
____ 4 m
____20 cm
- II. 1 700 m equivale a:
____ 1 km 7 m
____ 1 km 70 m
____ 170 dam
____1 km 700 m
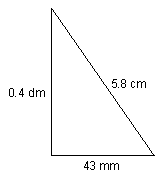
2. El perímetro del triángulo que se muestra en la figura es:

- a) ____ 141 cm
- b) ____ 14.1 cm
- c) ____ 1.41 cm
- d) ____14.1 dm
3. Cuánto cuestan 15.2 m de tela si el dm se vende a 1.25 pesos.
4. En qué unidad será más conveniente medir:
- e) ____ La distancia entre dos ciudades.
- f) ____ El largo del aula.
- g) ____ EL largo del lápiz.
Selecciona en cada caso la respuesta correcta:
a) 5 kg equivale a:
____ 14 lb
____ 15.4 lb
____ 700 g
____ 15.2 lb
Juan José pesa su pareja de conejos y obtiene como resultado que el macho tiene
8.8 lb y la hembra 4 kg . Juan José se sorprendió porque:
- i) ____ el macho pesa más que la hembra.
- j) ____ el macho está menos pesado que la hembra.
- k) ____ no se puede determinar cuál de los dos conejos pesa más.
- l) ____ los dos conejos pesan lo mismo.
De un saco de semillas se pueden llenar 80 bolsitas de 500 g cada una. ¿Cuántos kilogramos pesa el saco lleno?
- __ 4 kg
- __ 400 kg
- __ 40 kg
- __ 0.4 kg
MATERIA: PROPIEDADES, ESTADOS, CLASES, CAMBIOS Y TÉCNICAS DE SEPARACIÓN.
CONVERSIÓN EN UNIDADES DE LONGITUD, MASA, VOLUMEN, MOL Y TEMPERATURA
MATERIAL DE LABORATORIO
3°Copiar en el cuaderno o imprimir el siguiente formato y diligenciar la autoevaluación y coevaluación.
CRITERIO
|
AUTO
EVALUACION
|
COE
VALUACION
|
HETERO
EVALUACION
|
|
1
|
Busco
la excelencia en el desarrollo y presentación de tareas y trabajos.
|
|||
2
|
Asisto
puntualmente a clase.
|
|||
3
|
Presento
buena disposición en clase, soy atento y participativo.
|
|||
4
|
Me
preparo con anterioridad en las evaluaciones programadas.
|
|||
5
|
Mantengo
buena disciplina durante toda la clase.
|
|||
6
|
Respeto
a compañeros y docente.
|
|||
7
|
Solicito
la palabra y respeto la opinión de mi compañero (a).
|
|||
8
|
Acato
las normas de presentación personal establecidas por la Institución.
|
|||
9
|
Soy
ordenado y aseado con mi entorno.
|
|||
10
|
Cumplo
oportunamente con las actividades extra clase.
|
|||
TOTAL
|
Acciones de Mejora:
Acciones Correctivas:
Acciones Preventiva:
14-03-16
Exposición del trabajo sobre mezclas y técnicas de separación.
Explicar el tema de conversión en unidades de mol.
Explicar el tema de conversión en unidades de temperatura, teniendo en cuenta las siguientes equivalencias:
Explicar el tema de conversión en unidades de mol.
Explicar el tema de conversión en unidades de temperatura, teniendo en cuenta las siguientes equivalencias:
| Para convertir de Celsius a Fahrenheit, primero multiplica por 180/100, después suma 32 |
| Para convertir de Fahrenheit a Celsius, primero resta 32, después multiplica por 100/180 |
Nota: si simplificas 180/100 queda 9/5, y de la misma manera 100/180=5/9.
Así que la manera más fácil es:| Celsius a Fahrenheit | °F: ( 9/5)×°C + 32 |
| Fahrenheit a Celsius | °C: 5/9 x (°F - 32) |
Ejemplo 1
Convierte 26° Celsius (¡un día caluroso!) a Fahrenheit
Primero: 26° × 9/5 = 234/5 = 46.8
Después: 46.8 + 32 = 78.8° F
Después: 46.8 + 32 = 78.8° F
Ejemplo 2
Convierte 98.6° Fahrenheit (¡temperatura corporal normal!) a Celsius
Primero: 98.6° - 32 = 66.6
Después: 66.6× 5/9 = 333/9 = 37° C
Después: 66.6× 5/9 = 333/9 = 37° C
1. Se requiere fundir chocolate blanco entre 108 a 112 ºF, se tiene un termómetro que tiene un intervalo de -20 a 110ºC, servirá el termómetro para ello.
2. El punto de ebullición del etanol es 78,37 ºC, cuál es su equivalente en ºF y ºK
3. Convertir de grados kelvin a centígrados
-325 K
-400 K
-235 K
273 K
424 K
67 K
4. Convertir de grados Centígrados a grados Fahrenheit
20ºC
40ºC
-65ºC
-34ºC
34ºC
23ºC
5. Convertir de grados Fahrenheit a Centígrados
20ºF
40ºF
-78ºF
-34ºF
-345ºF
34ºF
6. Convertir de grados Centígrados a Kelvin
20ºC
40ºC
-78ºC
-34ºC
65ºC
87ºC
7. Entre 25°C y 380 K, cuál es la temperatura que representa el mayor valor.
7-03-16ACTIVIDADES DE CLASE:
Explicación del tema de mezclas, métodos de separación y densidad.
Resolver los siguientes ejercicios:
1.
Calcule la masa en lb de 250 ml de glicerina (C3H8O3), si su densidad es de 1,26 gr/ml.
2.
Calcula el volumen de agua en una piscina rectangular
cuyas medidas son 120 cm de alto, 10 m de largo y 70 dm de ancho. Exprese el volumen de la piscina en: ml, cm3
y m3.
3.
En un parque de la ciudad han construido un monumento con forma de esfera. Indica el
volumen y el área de esta esfera de 70 dm de diámetro, redondeando a dos cifras
decimales.
4.
Se utiliza una probeta de 108 gramos de masa, para medir la densidad de un
líquido. Luego de agregar 25 ml de líquido a la probeta se pesa de nuevo y su
peso es de 131 gramos. Cuál es la densidad del líquido.
5.
Una varilla de cobre tiene una
longitud de 15 cm. y un radio de 2cm, si la densidad del cobre es de 8.9gr/cm3.
Cuál es la masa de la varilla.
6.
Un bloque de plomo tiene 4 cm. de
largo, 1 cm. de ancho, 9 cm. de alto y tiene una masa de 400 gramos, Cual es la
densidad del bloque de plomo.
7.
Realizar las siguientes conversiones y determinar la densidad en cada caso:
- 630Kg a toneladas
- 250
lb a Kg
- 1800cm3 a
L
- 150
L a gal
8.
Una muestra de 400 ml de mercurio
líquido tiene una masa de 7,23 Kg. Cuál es la densidad de la sustancia en gr/cm3.
9.
El etilenglicol, es un anticongelante líquido,
tiene una densidad de 1.11 g/ml a 20 ºC
- Cuál es la masa en gramos de 452ml de
etilenglicol.
-
Cuál es la masa en Kg de 18.6 L de etilenglicol.
-
Cuál es el volumen en L que ocupan 23.9 Kg de la sustancia
10.
Calcula el volumen del sólido
irregular
Vcuerpo = Vfinal - Vinicial
ACTIVIDADES DE CLASE:
Repaso del tema de conversiones:
Masa
Volumen
Quiz del tema
Tablas de conversión
1 milímetro
|
=
|
0.0394 pulgadas
|
1 centímetro
|
=
|
0.3937 pulgadas
|
1 metro
|
=
|
1.0936 yardas
|
1 kilómetro
|
=
|
0.6214 millas
|
1 pulgada
|
=
|
2.54 centímetros
|
1 pie
|
=
|
0.3048 metros
|
1 yarda
|
=
|
0.9144 metros
|
1 milla
|
=
|
1.6093 kilómetros
|
1 centímetro cúbico
|
=
|
0.0610 pulgada
|
1 metro cúbico
|
=
|
1.3080 yardas cúbicas
|
1 litro
|
=
|
1.76 pintas
|
1 pulgada cúbica
|
=
|
16.387 centímetros cúbicos
|
1 pie cúbico
|
=
|
0.0283 metros cúbicos
|
1 onza líquida
|
=
|
28.413 mililitros
|
1 galón
|
=
|
4.5461 litros
|
1 miligramo
|
=
|
0.0154 granos
|
1 gramo
|
=
|
0.0353 onzas
|
1 kilogramo
|
=
|
2.2046 libras
|
1 tonelada
|
=
|
0.9842 toneladas
|
1 onza
|
=
|
28.35 gramos
|
1 libra
|
=
|
0.4536 kilogramos
|
1 tonelada
|
=
|
1.016 tonelada métrica
|
Centígrados a Fahrenheit
|
[Grados centígrados] x 9 : 5 + 32
| |
Fahrenheit a Centígrados
|
[Grados Fahrenheit] - 32 x 5 : 9
| |
Explicación del tema: Mezclas y métodos de separación, con la ayuda del siguiente vídeo:
3° Con lo que aprendiste del vídeo, completa la información solicitada en la siguiente tabla:
Técnica de separación
|
Estado de los componentes
|
Solubilidad
|
Tipo de mezcla
|
Material de laboratorio
|
Montaje
|
1
| |||||
2
| |||||
3
| |||||
4
| |||||
5
| |||||
6
| |||||
7
| |||||
8
| |||||
9
| |||||
10
|
4° Explica la siguiente afirmación:
Por qué es necesario conocer el estado físico, características y propiedades de los componentes de una mezcla?
1. Relaciona
a. Imantación
b. Evaporación
c. Filtración
d. Cristalización
e. Decantación
( ) Se calienta la disolución para separar el componente que tiene el punto de ebullición más bajo
.
( ) Es cuando se separa un sólido y un líquido en mezcla heterogénea haciendo pasar el líquido por un filtro.
( ) Se aprovecha las propiedades magnéticas. El componente es atraído por un imán, quedando separado del resto.
( ) El componente más denso cae al fondo y el menos denso se queda arriba
( ) Se deja reposar la disolución hasta que comiencen a aparecer pequeños cristales del sólido
5. Dibuje o pegue los diferentes métodos de separación de mezclas. Indique en el dibujo cada uno de los materiales empleados, y explique qué propiedades se tienen en cuenta para su separación.
3 6. Indica si la mezcla de las siguientes sustancias es homogénea o heterogénea. Justifica tu respuesta.
a. Azufre, sal y virutas de hierro
b. Arena, aceite y agua
c. Aceite, etanol y agua
d. Arena, sal y agua
Explicación del reconocimiento del material de laboratorio:
Practica de laboratorio:
Reconocimiento del material de laboratorio
Favor traer bata de laboratorio e impresa la siguiente guía:
Para resolver en CASA:
Ingresa al siguiente link
http://odas.educarchile.cl/objetos_digitales/odas_ciencias/22_jugando_separar/LearningObject/index.html y practica en casa las actividades allí sugeridas, ya que en clase se observará y evaluará.
Luego pon en practica lo aprendido, resolviendo la siguiente actividad:
Presentar en un informe escrito para el 07 -03 -16 y en grupos de dos estudiantes (si lo deseas) el desarrollo de la siguiente actividad:
Si deseas puedes ingresar al siguiente link en donde se encuentran las preguntas a continuación sugeridas.
Realiza y clasifica las siguientes mezclas:
A) Una mezcla con aserrín y sal.
1. ¿Qué tipo de mezcla es?
2. ¿Con que método separamos el serrín y la sal?
3. ¿Qué material podemos utilizar?
4. Haz un dibujo aplicando el método de separación. Pueden servir fotos.
B) Una mezcla de lentejas y clavos.
1. ¿Qué tipo de mezcla es?
2. ¿Con qué método podemos separar las lentejas y los y los clavos?
3. ¿Con qué material realizamos la separación de la
mezcla?
C) En esta experiencia necesitaras:
Una botella de plástico, un puñado de arroz,
lentejas, y garbanzos.
El procedimiento será el siguiente:
……………………………………………………………………………………………………………………...................................
en el recipiente de plástico y obtenemos una mezcla…………………………………………….
Propón tu otra mezcla de este tipo y elige
un método para separar sus componentes:
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
………………………………………………………………………………………………………
Una mezcla homogénea es aquella en la que no pueden
distinguirse los………………………………….
En esta 2ª experiencia necesitaras un vaso lleno de agua y una cucharada de azúcar.
El procedimiento será el siguiente:
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………
removemos y obtenemos una mezcla………………………………...
Propón tu otra mezcla de este tipo y elige
un método para separar sus componentes:
……………………………………………………………………………………………………………………
………………………………………………………………………
Expto. Separación de mezclas por imantación
1. Material que necesitaras:
limaduras de hierro, arena, un recipiente plano y un imán.
2. Procedimiento:
Mezclar la limadura de hiero con la arena en el recipiente.
Pasar el imán por encima de la mezcla.
3. Observación:
¿Qué pasa?.............................................
………………………………………………………………………………………………..
………………………………………………………………………………………………….
4. Explicación:
…………………………………………………………………………………………………
………………………………………………………………………
5. Dibujo o fotos de evidencia de la separación.
Expto. Separación de la sal y el agua
1. Material que necesitamos:
Sal, agua y un recipiente plano bastante grande.
2. Procedimiento:
Mezclamos el agua con la sal en el recipiente. Disolvemos bien hasta
que veamos que no admite mas sal.
Dejamos la mezcla al sol durante cuatro días.
3. Observación:
¿La mezcla que has preparado es homogénea o
heterogénea?..................................................................
¿Por qué?......................................................................
¿Qué pasa después de éste tiempo?
…………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………………………
4. Explicación:
……………………………………………………………………………………………………………………………………
5. Dibujo o foto de evidencia.
El tiempo necesario para completar el experimento depende:
a) de la temperatura ambiente
b) de la cantidad de agua
c) de la forma del recipiente de cristal.
Contesta:
La ……………………………….permite separar sustancias sólidas disueltas en el agua.
Una vez……………………….. el agua, en el fondo del recipiente queda la sustancia
disuelta.
La evaporación es mayor si …………………………….. la superficie del agua.
La evaporación es mayor si ………………………………. la cantidad de agua.
El tiempo que necesitamos para que se evapore toda el agua será
…………………….. si la temperatura ambiente es mayor.
Expto : separación de una mezcla de agua y azufre.
1. Material que necesitamos:
Azufre, agua, dos botellas de plástico, embudo y papel de filtro.
2. Procedimiento:
a) Mezclar el azufre con agua en una botella y agitamos
bien.
b) Colocar el embudo, con el papel de filtro encima, en
la segunda botella.
c) Finalmente vertimos sobre el filtro la mezcla de agua y
arena.
3. Observación:
¿Qué pasa?.............................................
………………………………………………………………………………………………..
………………………………………………………………………………………………….
4. Explicación:
…………………………………………………………………………………………………………………
………………………………………………………………………
5. Dibujo o fotos de evidencia
¿Qué otra mezcla se podría separar por filtración?
Tiza en polvo y agua………… sal y agua……………………
¿Cómo has sabido tu respuesta?..............................................................
……………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………….
Expto: separación de una mezcla de agua y glicerina
1.Material que necesitamos:
Agua, glicerina, dos botellas de plástico y un
vaso.
2. Procedimiento:
a) Mezclamos la glicerina y el agua en una botella y agitamos bien.
b) Dejamos reposar un tiempo la mezcla.
3. Observación:
¿Qué pasa?.............................................
………………………………………………………………………………………………..
………………………………………………………………………………………………….
Vuelve a girar la botella,¿qué pasa?........................
…………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………
4. Explicación:
…………………………………………………………………………………………………………………
………………………………………………………………………
La glicerina siempre quedará……………………ya que es menos denso que el agua.
Es exactamente lo mismo que ocurre cuando por accidente,
lamentablemente se derrama petróleo en los océanos ¿lo has notado?
Este mismo experimento lo puedes hacer con muchos otros
ingredientes. Por ejemplo, con un vaso con la mitad de agua y un poco de miel. Al tener la miel una densidad tan alta, se
mueve con mucha lentitud.¿Cuál es mas denso el agua o la miel?.............................................................
El aceite es menos denso que el vinagre. Por eso si los
mezclamos, la mezcla tiene dos capas, quedando el aceite en la parte………………..
Imagínate una pelota de plomo y otra exactamente igual de corcho. Si echáramos las dos pelotas en una piscina.¿Cuál de ellas flotaría?.................¿Por qué?.........................
……………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………..
Expto: El huevo que flota
1. Material que necesitamos:
Tres huevos frescos, agua, tres vasos de plástico
transparente, sal y una cuchara.
2. Procedimiento:
a) Echa unas ¾ partes de agua natural en cada uno de los vasos. Coloca los tres vasos con agua sobre una mesa.
b) En el primer vaso, añade 4 cucharadas grandes de sal y remueve durante unos 30 segundos con la cuchara.
c) Haz lo mismo con el segundo vaso y una vez listo, quita la mitad del agua salada y completa con agua natural.
d) Al tercer vaso no le añadas sal.
e) En cada uno de los vasos, añade 1 huevo y observa qué
sucede.
¿Qué sucede?
En el primer vaso (agua salada):…………………………………………….
En el segundo (½ agua salada y ½ agua natural)………………………
En el tercero (agua natural)………………………………………………………
4. Explicación:
¿Por qué ocurre esto?
Los huevos son más……………… que el agua dulce y se hunden en ella. Al disolver la sal en el agua aumentamos la ………………… de esta y por eso el huevo puede …………………….
¿Dónde es más fácil flotar en el mar o en la piscina?......... ¿Por qué?...........................................................
El Mar Muerto es uno de los más salados del mundo. A la gente le encanta ir allí,¿sabes por qué?.......................
……………………………………………………………………………………………………………….
Expto. Fabricamos estalactitas.
1. Material que necesitamos:
1 cacerola, 1 bote de sal fina, 1 cuchara sopera, 2 tarros de mermeladas vacíos, 1 cordel de nailon
trenzado de unos 30 cm de largo, 2 tuercas y 1 bandeja
2. Procedimiento:
a) Llenamos la cacerola con 1 litro de agua muy caliente.
b) Echamos 15 cucharadas soperas de sal.
c) Removemos hasta que la sal se disuelva.
d) Colocamos los tarros encima de la bandeja y llenamos con la disolución.
e) Ponemos una tuerca en cada extremo del cordel y lo
metemos en los tarros separando los tarros unos 15 cm
aproximadamente.
f) Presionamos sobre el cordel, entre los tarros, para crear un pequeño desnivel. Este permite que aparezca una gota y caiga cada 3 minutos, más o menos.
g) Las gotas no pueden aparecer ni demasiado rápido, ni
demasiado lento. Si las gotas aparecen muy despacio, acerca los tarros.
h) Colocamos la bandeja en lugar aislado durante una semana. Si queda poca agua en los tarros, rellena con más agua salada. Si es posible, es mejor realizar el experimento en un días calurosos ya que las altas temperaturas favorecen la evaporación.
Y a esperar.
3. Observación:
¿Qué pasa?.............................................
………………………………………………………………………………………………..
………………………………………………………………………………………………….
4. Explicación:
…………………………………………………………………………………………………
…………………………………………………………………………………………………
Dibuja o toma fotos.
22-02-16
Hola estudiantes:
Los invito a reflexionar sobre la necesidad de asumir el verdadero rol del estudiante: Inquieto por saber, dinámico, exigente con sigo mismo, entre otros.
Piensen en la necesidad de lograr unos excelentes resultados en las PRUEBAS SABER, por lo tanto deben mejorar aspectos académicos del grado décimo.
ACTIVIDADES DE CLASE:
Revisión y sustentación de los ejercicios referentes a Longitud, masa y volumen.tomados del siguiente link:
Resolver: http://matebrunca.com/wp-content/uploads/2014/06/fisica-conversion-unidades.pdf
Quiz del tema: Conversión en unidades de longitud.
Resolver en clase el siguiente taller:
CONVERSIÓN EN UNIDADES DE LONGITUD. MASA, VOLUMEN, TEMPERATURA, MOL, ENERGÍA
1º Adicionar las siguientes longitudes y expresar su respuesta en metros:
3 4 -2 5
3.8X10 cm + 2.5X10 mm + 4.82X10 Km + 500 pies + 5.2X10 Mm
2º Adicionar las siguientes masas y expresar su respuesta en gramos:
6 8 -3 -15
4.4X10 Kg + 3.7X10 Pg. + 7.6X10 ug + 200 Libras + 25.1X10 t
3º Adicionar los siguientes volúmenes y expresar su respuesta en Litros:
-5 4 7 3 3
2.1X10 Gl + 7.5X10 ml + 65.5X10 cc + 20.8 m + 35.4X10 dm
15-02-16
ACTIVIDADES DE CLASE:
Explicación del sistema de medidas, con la proyección de un vídeo:
http://www.ilse.esc.edu.ar/MATERIAL_FISICA_QUIMICA/Betty/Trabajo%20practico%20inicial%20Quimica%202014.pdf
08-02-16
“CUANDO ENTIENDO EN QUÉ ESTOY FALLANDO Y
BUSCO LA MANERA DE CORREGIRLO EMPIEZO A SER
EXCELENTE”
Pregunta Problematizadora:
¿Por qué una limonada es una sustancia impura?
Actividades en clase:
1°Explicación del tema: Propiedades de la Materia
Proyección del siguiente vídeo:
1°Explicación del tema: Propiedades de la Materia
Proyección del siguiente vídeo:
2° Resolver la siguiente actividad:
TALLER: PROPIEDADES DE LA MATERIA
1. Clasificar:
Sustancia
|
Propiedad
|
P. Física
|
P. Química
| |||
Extensiva
|
Intensiva
|
organolépticas
|
General
|
Especifica
| ||
El agua es incolora
| ||||||
El agua ebulle a 100°C
| ||||||
Los metales se oxidan con facilidad.
| ||||||
500 g de Sulfato férrico
| ||||||
1L de Ácido Sulfúrico
| ||||||
El Hidróxido de Sodio reacciona con facilidad con el Ácido Clorhídrico para formar Cloruro de Sodio (sal
| ||||||
El ácido clorhídrico tiene sabor amargo
| ||||||
La densidad del alcohol etílico (C2H5OH) es de 0.78 g/cc
| ||||||
Los no metales reaccionan lentamente
| ||||||
El diamante ocupa el puesto No. 10 en la escala de dureza de Mohs
| ||||||
El punto de fusión del hierro es 1.538 °C
| ||||||
El cobre es dúctil
| ||||||
Los metales se oxidan facilmente
| ||||||
2. Establece claras diferencias entre:
Propiedad Física y Propiedad Químca
Propiedad General y Especifica
ACTIVIDADES DE CLASE:
1° Resolver:
1. De las siguientes propiedades, cuáles son generales y cuáles son especificas?
1° Resolver:
1. De las siguientes propiedades, cuáles son generales y cuáles son especificas?
Incomprensibilidad de los solidos _______ Peso_____ Dureza_______ Brillo_____
Masa______ Porosidad________ Tenacidad_______ Color________ Volumen______
1Kg de NaCl:__________ El azufre es amarillo:_____________ El Hierro reacciona con facilidad con los ácidos:__________ Los sólidos tienen VOLUMEN definido:_____________ Todos los objetos experimentan la gravedad:________
2. Cuáles son propiedades extensivas (son propiedades que dependen de la cantidad de sustancia que se tome) o intensivas (Son propiedades que no dependen de la cantidad de sustancia que se tome):
Volumen:________ Color:_________ Viscosidad:________ Densidad:_______
Masa:_______ Conductividad eléctrica:__________ Punto de fusión:_______
Inercia:_______ Brillo:________ Elasticidad:________ Dureza:_____________
1 3. Señala las cosas que se pueden definir como materia. Justifica tu respuesta.
a. Aire
b. Amor
c. Agua
d. Silla
e. fuego
f. música
Observa el siguiente mentefacto:
Resuelve:
1. Diferencie cuáles son compuestos y cuáles son elementos:
H2O:______ H:_______ O3:_________ KMnO4:_____________ NH3:____________ CO:________
Hg:________ N2:_________ Cl:__________ Ca3(PO4)2:_____________Li:_____________
2.
1
2. En una tabla clasifique como elemento, compuesto, sustancia o mezcla
a. Una coca cola
b. Gas doméstico
c. Aluminio
d. El agua de acueducto
e. La gasolina
f. Dióxido de Carbono
g. El carbón de leña
h. El vapor de agua
i. Hierro
j. Bicarbonato de sodio.
k. Perfume
l. Ácido sulfúrico
m. Mayonesa
n. El aire
o. El polvo de hornear
p. un arete de acero
q. Glucosa
r. Barras de oro
s. Un cubo de azúcar
t. La leche
3. Indica la propiedad de la materia que está establecida en cada uno de los enunciados:
- La resistencia que opone un ladrillo para incrustar un lápiz con punta, es una propiedad llamada__________________
- Cuando un sólido como la plata, se somete a altas temperaturas (965°C), se funde, pasando al estado líquido. Esta propiedad es llamada______________
- El oro es un metal, puede estar en forma de polvo, pepitas, el hombre la transforma en láminas, para elaborar anillos. A esta propiedad es llamada________________
- La resistencia que opone el talco a ser rayado es mínima. A esta propiedad es llamada_______________
- El alambre de cobre se deja convertir en hilos, por ello se puede utilizar en los cables eléctricos, tiene la propiedad de materia, llamada
- Algunos materiales se fracturan con facilidad, entre ellos el vidrio, es una propiedad llamada_______________
Explicación de los siguientes temas:
Clases de materia
Estados de la materia
cambios de estado de la materia

1. 1°Indicar el cambio de estado en cada una de las imágenes. Explica.
2° Clasifica las siguientes sustancias en Puras e Impuras:
Cloruro de sodio (NaCl):______Acero:_______Vinagre:_______Plata (Ag):______
Mercurio (Hg):______Aire:______ Agua de mar:_____Oxido ferroso (FeO):______
3º Clasifique las siguientes sustancias en Simples o Compuestas:
Oro (Au):______Ácido Sulfúrico (H2SO4): _____Nitrógeno gaseoso (N2):____Cloro (Cl):_____Carbonato de Calcio (CaCO3)______ Sodio (Na):_____
4º Clasifique los siguientes cambios en Físicos o Químicos:
Hervir el agua:_______ Fotosíntesis:______ Fundir un metal:_______ preparar una limonada:________ Formación de los óxidos en los metales:_____________
5º Clasifique las siguientes propiedades en Físicas o Químicas:
La densidad del agua es 1g/ml:____ El agua embulle a 100ºC:_____La Combustión de la madera:_____ La fermentación:_____ Los ácidos son amargos:_____
2.
6°Clasifique los siguientes cambios en Físicos o Químicos:
Oxidación de una moneda:____________Hervir el agua:_______ Fotosíntesis:______ Fundir un metal:_______ preparar una limonada:________ Formación de los óxidos en los metales:_____________ Preparación de Kumis:________ Encender un fósforo:___________ Derretir una paleta:___________ Congelar el agua:______________





















Buenas tardes profesora astrid,para confirmarle la asistencia del grado décimo para el día 04 de junio , alas siete de la mañana para recuperar las horas perdidas por los dos puentes festivos , agradezco su atención
ResponderEliminarLe agradezco su información. Nos vemos Dios mediante el día sábado 4 de junio.
EliminarBuenas noches, profesora astrid era para preguntarle por los niños que deben desarrollar el taller tipo icfes y solamente hay tres preguntas nada mas,Pues faltan por que son varios alumnos;También era para preguntarle a que hora entramos al fin.¿si el sábado si a la "7:00" o "7:30" y la hora de salida?
ResponderEliminarBuenas noches, profesora astrid era para preguntarle por los niños que deben desarrollar el taller tipo icfes y solamente hay tres preguntas nada mas,Pues faltan por que son varios alumnos;También era para preguntarle a que hora entramos al fin.¿si el sábado si a la "7:00" o "7:30" y la hora de salida?
ResponderEliminarSiento no haber resuelto la duda oportunamente. Ya en el blog esta publicado lo de la clase del 13 de junio.
ResponderEliminarEste comentario ha sido eliminado por el autor.
ResponderEliminarBuenas tardes Profesora Astrid.
ResponderEliminarQueríamos saber quienes son los alumnos que presentan falencias o van perdiendo para así mismo hacer el taller de recuperación por favor dejarnos el listado.
Muchas gracias, Feliz tarde.
Buenas noches Profesora Astrid , era para confirmarle que nosotros ingresamos a estudiar el día 12 de julio .
ResponderEliminarMuchas gracias , feliz noche
Gracias por su información. Feliz noche
ResponderEliminarQuien me ayuda por fa?? Completa la siguiente tabla con una X en el cuadro correspondiente
ResponderEliminarSustancia
Mezcla
Sustancia pura
Heterogénea
Homogénea
Compuesto
Elemento
Azúcar
Agua de mar
Aire
Mayonesa
Gasolina
Hielo seco
Amoniaco
Detergente
Alambre de cobre
Gas que expele el exhosto de un auto
Excelente material educativo pero no puedo descargar dicha información.
ResponderEliminarsimple y llanamente, el Sr. Pedro es la persona más amable y el mejor oficial de préstamos a su servicio. Tuvimos un camino muy accidentado durante todo el proceso de renovación de nuestro negocio, debido a circunstancias sin fondos. El Sr. Pedro se mantuvo al tanto de todas las partes para asegurarse de que todo siguiera el rumbo a fin de cumplir con nuestra fecha límite ajustada para cerrar nuestro préstamo. Agradecemos todo lo que hizo por nosotros y lo recomendamos a él y a su compañía de préstamos a cualquiera que busque obtener financiamiento. gracias de nuevo mr pedro. comuníquese con el señor pedro jerome en: pedroloanss@gmail.com también en whatsapp: + 1-8632310632.
ResponderEliminar